Patrones espacio-temporales asociados a características del sedimento respecto a la disponibilidad de áreas de anidación para tres especies de tortugas el Amazonas colombo-peruano
Spatio-temporal patterns associated with the sediment characteristics regarding the availability of nesting areas for three species of turtles in the Colombian-Peruvian Amazon
Valentina Franco-Arciniegas1
Javier Díaz-Perdomo2
Recibido 09 de enero de 2023; aceptado 30 de junio de 2023
Resumen
El análisis de patrones espaciales, temporales y ambientales en las áreas de anidación de las tortugas es indispensable para entender los factores asociados a su supervivencia, así como para lograr un óptimo desarrollo en las labores de conservación. El objetivo fue identificar patrones de influencia espacial asociados a características de sedimentos respecto a la disponibilidad de áreas de anidación para tres especies de tortugas, en un marco multitemporal. La metodología comprende dos fases. La primera fase de campo realizada durante junio y agosto de 2019 se hizo parte de las actividades de conservación que desarrollan cinco comunidades indígenas, fueron visitadas seis playas y se tomaron muestras del suelo (por especie) de los lugares donde las hembras anidaban. La segunda fase de oficina, se llevó a cabo un análisis de laboratorio de las características físicas y químicas de las muestras de suelo. Por otro lado, se realizó una clasificación supervisada a partir de imágenes satelitales Landsat 5, 7 y 8 correspondientes al mes de septiembre para cada año de actividad del programa de conservación. Fueron analizadas en total 14 muestras de suelo. Estas evidenciaron las condiciones idóneas y/o de preferencia por las tortugas para desarrollar los procesos de oviposición referente a textura, color, densidad, pH, materia orgánica, presencia de alófanos (material volcánico) y carbonatos. En paralelo, se obtuvo un total de 12 clasificaciones supervisadas en las que se evidenció variabilidad asociada con la disponibilidad de las seis playas en términos de tamaño, forma y ubicación, así como la aparición de dos nuevas extensiones y el cambio en la morfología del río. En conclusión, en la ecología reproductiva de las tortugas de río intervienen diversos factores geoespaciales y multitemporales que se relacionan con las condiciones del ecosistema acuático, así como con la disponibilidad y características propias de las playas de anidación.
Palabras clave: Amazonas, Podocnemis, anidación, suelo, multitemporal, tortuga de río.
Abstract
The analysis of spatial, temporal, and environmental patterns of the availability of turtle nesting areas is essential for the understanding of the factors associated with their survival, as and for an optimal development of conservation activities. The objective was to identify patterns of spatial influence associated with sediment characteristics regarding the availability of nesting areas for three species of turtles, in a multitemporal framework. The methodology comprises two phases. The first field phase was carried out during July and August of 2019, we participated in conservation activities being carried out by five indigenous communities, we visited six beaches and took soil samples from places where the females of each species nested. In the second office phase, an analysis was carried out on a laboratory analysis of the physical and chemical characteristics of the soil samples was carried out. A supervised classification of beaches was done from satellite images Landsat 5, 7 and 8, from September of each year of activity of the conservation program. A total of 14 soil samples were analyzed. They showed the ideal conditions and/or preference of turtles for oviposition processes. Such conditions included texture, color, density, pH, organic matter, presence of allophones (volcanic material) and carbonates. A total of 12 supervised beach classifications were obtained. The availability of the six beaches had remarkable variability in terms of size, shape, and location. Two new beach extensions and changes in river morphology were observed. In conclusion, in various geospatial and multi-temporal factors influence the reproductive ecology of river turtles. These are related to the conditions of
the aquatic ecosystem, and the availability and characteristics of nesting sites.
Key words: Amazon, Podocnemis, nesting, soil, multitemporal, river turtle.
1. Introducción
Durante la formación del río Amazonas, hace 10.5 millones de años, se originaron una serie de hábitats terrestres y acuáticos que favorecieron la generación de una alta diversidad de especies (Figueiredo, Hoorn, van der Ven & Soares, 2010). Desde el punto de vista de su cuenca, se considera como una de las biorregiones más importantes del mundo, su área de drenaje alberga diversos ecosistemas que, además de sustentar una gran riqueza biótica, facilitaron la adaptación de varias culturas (Pineda, 2013).
Dentro de las especies acuáticas y subacuáticas que cohabitan la Amazonía, en este escrito se enfatizó en el estudio de la familia Podocnemididae, representada en la región por tres especies: Podocnemis expansa, P. unifilis y P. sexcubertulata, distribuidas al interior de la frontera colombo-peruana y consideradas altamente amenazadas (Pezzuti, Lima, da Silva, & Begossino, 2010). Algunos factores que inciden en esta consideración son: la degradación del hábitat, la caza excesiva y la presencia de actividades humanas en las zonas de anidación, generando la compactación del sustrato (Ceballos-Fonseca, 2004) y por lo tanto, una alteración en el desarrollo de los nidos.
Desde el año 2008, la Asociación Familiar Curuinsi Huasi (“Casa de la hormiga” en lengua Cocama), ubicada en la Amazonía colombiana, junto con
la Fundación Biodiversa Colombia, iniciaron un programa de conservación con el objetivo de proteger y establecer puntos de control en algunas playas (Arbeláez, Gutiérrez, Cadavid, Premauer & Vargas-Ramírez, 2009). Estas son áreas de gran importancia ya que allí ocurre la selección de lugares por parte de las hembras de tortugas para la anidación y posterior oviposición de los huevos (Márquez, 2000). En la actualidad, son cinco comunidades partícipes del programa: Santa Sofía, Nuevo Jardín y El Progreso (Colombia), Yahuma I y El Barranco (Perú) (Fundación Biodiversa Colombia, 2015).
La dinámica relacionada con la preferencia y disponibilidad de playas depende de varios aspectos: su extensión, ubicación, la estructura de la vegetación, las características del río, la disponibilidad de luz y el alimento entre otros factores (Rosenzweig, 1981; González-Zárate, Montenegro, & Castaño-Mora, 2011). Las playas tienen la particularidad de ser inestables, cambian su configuración, perfil y base con el paso del tiempo. Esas variaciones se dan por causa de la influencia del “pulso de inundación” y “la dinámica pluvial del río Amazonas que influye directamente en las condiciones de formación, estabilidad y desaparición de las barras de arena” (Junk & Wantzen, 2004; Camacho & Quiñonez, 2020), asimismo contribuyen el tipo de oleaje, el viento, las características de los sedimentos y demás (Medina, Losada, Losada, & Vidal, 1995). Por ejemplo, en sedimentos de tipo arenoso muy compactados, así como en suelos granulométricos muy gruesos y/o finos, la diversidad de especies disminuye y se presentan cambios en la compactación afectando el anidamiento (May, MacDonald, Méndez, & Muñóz, 2018).
Por lo tanto, el estudio de las playas de anidación y sus características granulométricas es fundamental ya que es allí donde el ciclo reproductivo se desarrolla (Hernández, 2020). Evaluar dichos factores, así como los cambios que puedan presentar, es necesario para establecer su impacto en la diversidad de las especies de tortugas y la distribución de sus poblaciones en una escala espacio-temporal (González-Zárate, Montenegro, & Castaño-Mora, 2011). El objetivo de este estudio fue identificar los patrones de influencia en la disponibilidad
de áreas de anidación para tres especies de tortugas en el río Amazonas, teniendo en cuenta los tipos de sedimentos presentes en tales zonas.
2. Área de estudio
El programa de conservación se desarrolla en un tramo del río Amazonas en el que la frontera entre los países de Colombia y Perú se diluye. Las comunidades colombianas hacen parte del Resguardo Indígena de Santa Sofía ubicado en la subregión de la Amazonía suroriental (SIAT-AC, 2015) y las comunidades peruanas están ubicadas en la Provincia Mariscal Ramón Castilla en el departamento de Loreto. Como punto de referencia se tiene la isla de Corea a 30 km de la ciudad de Leticia y a 30 km del Parque Nacional Amacayacu. En total son seis playas de conservación aledañas a la isla. Estas son conocidas como Playa Alta (3° 59' 45'' S & 70° 10' 07'' W), Playa Media (4° 01' 43.32'' S & 70° 07' 22'' W), Playa Baja (4° 03' 11'' S & 70° 06' 36'' W), Playa Tori (4° 02' 34'' S & 70° 07' 11.01'' W), Playa Corea (4° 0' 26.44" S & 70° 9' 42.63" W) y Playa Arara (4° 04' 14'' S & 70° 04' 10.93'' W) (R. Conde y N. Carihuasari,3 comunicación personal, 20 de junio de 2019) (Figura 1).
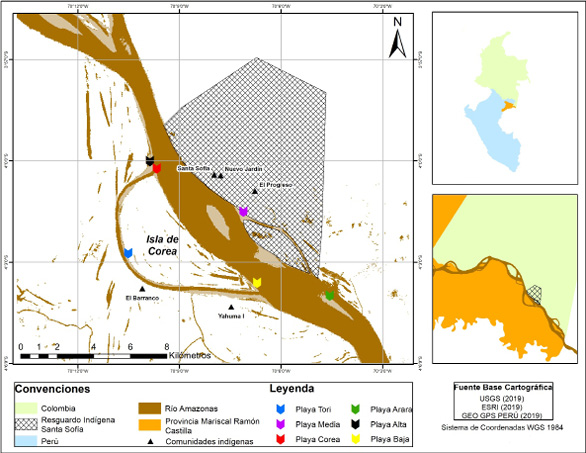
Figura 1. Mapa de ubicación: Frontera en la Amazonía colombo-peruana. Fuente: elaboración propia.
3. Materiales y métodos
3.1 Fase de campo
En junio y agosto de 2019, se hicieron recorridos en bote durante la noche para visitar cada una de las playas. De acuerdo con los hábitos de cada una de las especies de tortuga, las rondas se realizan en diferentes horarios siempre utilizando una linterna de luz roja para no perturbar a los organismos. En el caso de P. expansa únicamente se hacen seguimientos entre las 12 am y las 2 am, mientras que para P. unifilis y P. sexcubertulata el rastreo se ejecuta durante toda la noche. Esta técnica se basa en la experiencia y conocimiento de las especies por parte de las comunidades locales. Cuando una hembra era encontrada depositando sus huevos, se esperaba a que terminara el proceso para posteriormente tomar 1kg de suelo. Esto con la finalidad de tener una muestra del sustrato por especie en cada una de las playas, es decir, un total de 18 muestras. No obstante, no fue posible obtener 4 muestras para P. expansa pues la especie no anidó en: Playa Alta, Baja, Tori y Corea durante esta fase.
3.2 Fase de oficina
3.2.1 Análisis de laboratorio
Para las muestras que se recolectaron en las playas se realizaron análisis relacionados con la determinación de ciertas características físicas: Textura, por medio del método del tacto que consiste en humedecer un puñado de suelo, amasarlo y hacer plastas observando la forma que adquiere (USDA & NRCS, 2000). Color, a través de la tabla de colores de Munsell (Andrades, Molenir, & Masaguer, 2015). Densidad real, obteniendo el volumen del suelo por medio de un picnómetro (OILM, 2011). En cuanto a las características químicas, se analizó el pH a través del potenciómetro (McKean, 1993), presencia de alófanos por medio de una reacción entre floruro de sodio (NaF) con fenolftaleína (fenol 1%) y el suelo (C. Garavito, comunicación personal, 5 de septiembre de 2019), materia orgánica aplicando gotas de peróxido de hidrógeno (H2O2) a las muestras (Lizcano et al., 2017) y carbonatos sometiendo el suelo a la acción de ácido clorhídrico (HCl) (FAO, 2021).
3.2.2 Análisis multitemporal
A partir de imágenes satelitales Landsat 5, 7 y 8, se realizó una clasificación supervisada desde el año 2008 hasta 2019. Se partió de cierto conocimiento de la zona del estudio, adquirida por la experiencia previa y trabajo de campo desarrollados en los meses de junio-agosto de 2019. Logrando establecer sobre la imagen, áreas lo suficientemente representativas para la composición de la leyenda (Reuter, 2002), es decir, se ejecutó un reconocimiento de patrones espaciales para determinar los valores de cada pixel a partir de datos de referencia. En primer lugar, se desarrolló una combinación de bandas para identificar fácilmente los diferentes tipos de cobertura. Teniendo en cuenta que cada satélite posee bandas espectrales diferentes, se utilizó una combinación única. Para los satélite Landsat 5 y Landsat 7 la combinación de bandas correspondió a la 4, 5, 3 mientras que para Landsat 8 fue 5, 6, 4 (Matellanes, 2017). En segundo lugar, se ejecutaron correcciones de bandeo a las imágenes tomadas por el satélite Landsat 7 ya que este presenta una mala calibración que ha generado la aparición de líneas de ausencia de información (López & Torres, 2017). Por otro lado, muchas de las imágenes utilizadas tenían alta nubosidad y sombras, por lo tanto se ejecutó un mosaico entre dos fotografías (tomadas dentro de un mismo periodo de tiempo) permitiendo remover en su totalidad estas características (Meaden & Kapetsky, 1992).
4. Resultados
4.1 Análisis de laboratorio
En total se analizaron 14 muestras de sedimento correspondientes a las seis playas que frecuentaron las tortugas. La especie P. expansa fue excluida del análisis debido a la escasez de datos. De seis playas, solo en dos fueron encontrados nidos. Sin embargo, en la Tabla 1 fue plasmada la información para evidenciar la escasez de esta especie en comparación con las demás. En cuanto a las características físicas, respecto a textura se encontraron las siguientes fracciones: Arena Gruesa (AG) y Limo (L). La fracción AG tuvo mayor predominancia al registrarse en una proporción 9:14. Referente al color, se evidenciaron tonalidades: marrón dentro del matiz 2.5Y, estas corresponden a marrón oliva oscuro (2.5Y 3/3) y marrón grisáceo muy oscuro (2.5Y 3/2); en el que 2.5Y 3/3 tuvo mayor repetición, presente en un total de 8 muestras. Los valores de densidad real se encontraron dentro de la escala 0.4-0.78 g/cm³. En cuanto a las características químicas, se obtuvo un rango de pH de 6.08-6.65, correspondiente a suelos neutros con tendencia hacia la acidez. La materia orgánica y la presencia de alófanos fue positiva en todas las muestras tomadas, mientras que, para carbonatos, los resultados demostraron la ausencia de estos (Tabla 1).
4.2 Análisis multitemporal
La corrección de bandeo se ejecutó exitosamente para las imágenes satelitales de los años 2008, 2012, 2013, 2014, 2016, 2017 y 2018. Respecto a los mosaicos, se logró remover en su totalidad nubes densas y sombras para los años 2008, 2009, 2011, 2013, 2014, 2015, 2017, 2018 y 2019. Durante el desarrollo de la combinación de bandas se visualizó una diferenciación considerable entre la cobertura del suelo y los cuerpos de agua. Finalmente se obtuvo un total de 12 clasificaciones supervisadas que evidencian la variación notable, en términos de tamaño, forma y ubicación, que año a año presentan las playas dentro de una escala espacio-temporal (Figura 2), así como la aparición de dos nuevas áreas, a partir del año 2017 en el curso del río, las que han aumentado su extensión con el paso del tiempo (resaltadas en la figura con un ovalo de línea punteada). También se evidenció un cambio en la morfología de la isla de Corea, se observa más alargada y puntiaguda en el costado suroriental mientras que el brazo del río, ubicado al suroccidente de la isla, se ha hecho más angosto, delimitado por un rectángulo (Figura 2).
Tabla 1. Resultados de los análisis de laboratorio, características físico-químicas del suelo por playa y especie
|
Característica |
Playa |
|||||
|
Textura |
Alta |
Media |
Baja |
Tori |
Corea |
Arara |
|
P. sexcubertulata |
AG |
AG |
AG |
Limoso |
AG |
AG |
|
P. expansa |
N/A |
AG |
N/A |
N/A |
N/A |
AG |
|
P. unifilis |
Limoso |
AG |
Limoso |
Limoso |
Limoso |
AG |
|
Color |
||||||
|
P. sexcubertulata |
2.5Y 3/2 |
2.5Y 3/3 |
2.5Y 3/3 |
2.5Y 3/2 |
2.5Y 3/3 |
2.5Y 3/3 |
|
P. expansa |
N/A |
2.5Y 3/3 |
N/A |
N/A |
N/A |
2.5Y 3/3 |
|
P. unifilis |
2.5Y 3/2 |
2.5Y 3/3 |
2.5Y 3/2 |
2.5Y 3/2 |
2.5Y 3/2 |
2.5Y 3/3 |
|
Densidad real (g/cm³) |
||||||
|
P. sexcubertulata |
0.78 |
0.53 |
0.76 |
0.77 |
0.55 |
0.61 |
|
P. expansa |
N/A |
0.63 |
N/A |
N/A |
N/A |
0.5 |
|
P. unifilis |
0.74 |
0.68 |
0.71 |
0.72 |
0.4 |
0.52 |
|
pH |
||||||
|
P. sexcubertulata |
6.08 |
6.14 |
6.12 |
6.39 |
6.32 |
6.64 |
|
P. expansa |
N/A |
6.12 |
N/A |
N/A |
N/A |
6.44 |
|
P. unifilis |
6.28 |
6.35 |
6.17 |
6.21 |
6.38 |
6.65 |
|
Materia orgánica |
||||||
|
P. sexcubertulata |
Si |
Si |
Si |
Si |
Si |
Si |
|
P. expansa |
N/A |
Si |
N/A |
N/A |
N/A |
Si |
|
P. unifilis |
Si |
Si |
Si |
Si |
Si |
Si |
|
Alófanos |
||||||
|
P. sexcubertulata |
Si |
Si |
Si |
Si |
Si |
Si |
|
P. expansa |
N/A |
Si |
N/A |
N/A |
N/A |
Si |
|
P. unifilis |
Si |
Si |
Si |
Si |
Si |
Si |
|
Carbonatos |
||||||
|
P. sexcubertulata |
No |
No |
No |
No |
No |
No |
|
P. expansa |
N/A |
No |
N/A |
N/A |
N/A |
No |
|
P. unifilis |
No |
No |
No |
No |
No |
No |
Fuente: elaboración propia.
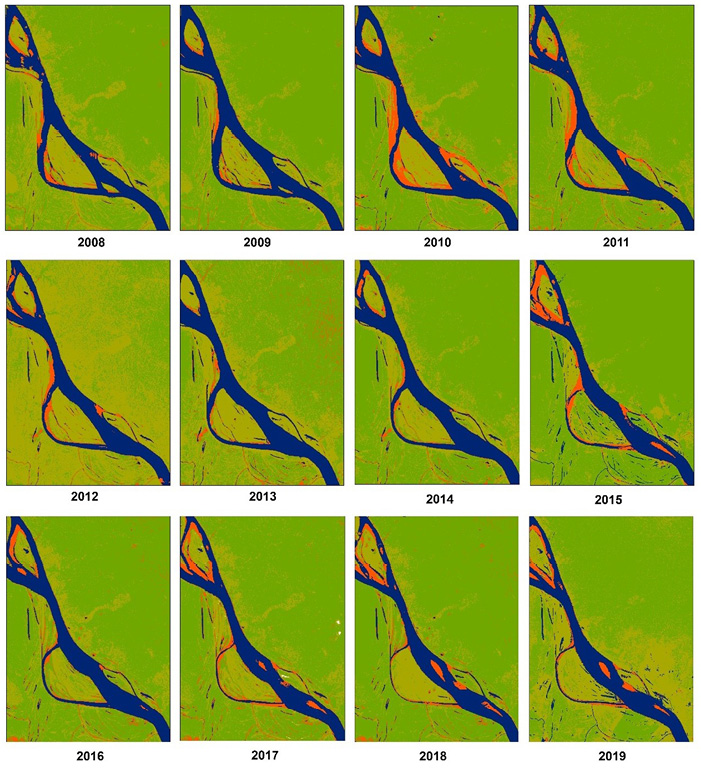
Figura 2. Multitemporal de la disponibilidad de las playas de anidación, años 2008-2019. Fuente: elaboración propia.
5. Discusión
5.1 Análisis de laboratorio
En las playas: baja, alta y Corea la textura del suelo es mixta, lo que corresponde con las características de los “sedimentos transportados por un río [el cual] no está constituido por partículas idénticas” (Valenzuela-Carpio, 2019). Los suelos de tipo arenoso y limoso representan texturas óptimas para la anidación debido a su rápida permeabilidad y compactación, facilitando el humedecimiento de la arena y previniendo que el nido se llene del sustrato (Martínez-Callejas, S.; Trujillo, F.; Quinche, C; Millán, J. & Antelo R., 2013). El color del suelo influye en la temperatura de este, aquellos que son oscuros absorben más la radiación solar, factor importante en la determinación del sexo de las tortugas (Bull, 1980). Si la temperatura incrementa 1°C, la probabilidad de que nazcan más hembras es mayor, pero si disminuye 1°C, serán más machos (Martínez-Callejas et al., 2013). Es decir, es necesario un balance en la temperatura de los sustratos para que haya una equivalencia entre el nacimiento de hembras y machos. La densidad de los suelos exhibe alta variabilidad, un valor de 0.5 g/cm³ hace alusión a suelos con muchos espacios y por lo tanto, buen drenaje (GLOBE, 2005). Esta característica se relaciona con la textura. La compactación de los suelos en las playas es baja en estado seco, el sustrato presenta espacios entre los granos que la conforman y, al entrar en contacto con el agua, permiten que se filtre rápidamente para favorecer el moldeo del nido. En cuanto al pH los resultados obtenidos evidencian suelos básicos y ligeramente ácidos cuya disponibilidad de nutrientes es alta (Asociación Española de Fabricantes de Agronutrientes, 2019). No obstante, se determinó que esta no es una característica influyente en la selección de zonas para la oviposición ya que los huevos no necesitan de nutrientes externos para su desarrollo. Sin embargo, se infiere que los niveles obtenidos son óptimos para la anidación puesto que un pH ácido podría provocar alteraciones en la calcificación de los caparazones de los neonatos (Acuña, Castaing, & Flores, 1983).
Las pruebas cualitativas aplicadas registran la presencia de materia orgánica, que en exceso puede fomentar la presencia de hongos, específicamente se ha encontrado que Fusarium solani afecta el desarrollo de los huevos, incluso causando la muerte masiva dentro del nido (Sarmiento-Ramírez et al., 2010). Sin embargo, teniendo en cuenta los registros recolectados durante los años activos del programa de conservación de tortugas en el área de estudio, se considera que los valores de materia orgánica son óptimos, hasta el momento, los hongos no han sido un factor de riesgo para el desarrollo embrionario. En cuanto al componente de alófanos, su presencia se deriva de la formación geológica del ecosistema amazónico, el cual tiene rocas magmáticas e ígneas de la época precámbrica (Gardi et al., 2014). No obstante, se considera que estos elementos podrían ser trasportados desde otros lugares a través del viento o de las desembocaduras del río. Por último, la carencia de carbonatos en las muestras analizadas se relaciona con la escasa vegetación en suelos (Santaella & González, 1965) tal y como se evidenció en las playas que utilizan las tortugas. Estos elementos se acumulan en lugares donde hay poca erosión, permitiendo deducir que en las zonas de anidación de las tortugas se presenta tal fenómeno. Actualmente no se han documentado afectaciones a los nidos por erosión, sin embargo es importante desarrollar investigaciones encaminadas a este parámetro ya que se conoce que fomenta el descubrimiento de nidos y la consecuente mortalidad embrionaria (Ceballos-Fonseca, 2004).
Con el fin de explorar los datos de forma cuantitativa, se escogieron algunas de las variables de acuerdo con las siguientes condiciones: presencia de la medición y variación entre ellas. Sus valores se agruparon en una tabla relacionando lugares (playas) y especies con las variables: densidad, pH y textura (Tabla 2). Para la variable textura se asignaron valores numéricos de acuerdo con la clasificación encontrada durante el desarrollo de la metodología, se estableció un mayor valor a la textura de tipo Arena Gruesa (6) seguida por Limo (3). En el resumen de la estadística descriptiva (Tabla 3), se puede observar que se incluyó el cálculo del coeficiente de variación en porcentaje que se utiliza para “comparar la variabilidad de los datos en igual o diferente escala” (Vásquez y Caballero, 2011). Los valores de densidad y pH del suelo presentan bajo porcentaje de variabilidad y se considera por lo tanto que los datos presentan mayor homogeneidad. Con respecto a la textura, el valor corresponde a una dinámica moderada, de lo que se podría asumir que los datos son menos uniformes que las otras variables, no obstante, es necesario analizar esto con cuidado porque corresponden a categorías asignadas. De forma complementaria se realizaron pruebas de correlación entre todas las variables y de forma individual, obteniéndose resultados no significativos. Lo anterior demuestra que con esta serie de datos es imposible aseverar que las variables medidas influyan en la escogencia de las playas y en la posible utilización diferencial por especies de tortugas.
Tabla 2. Correlación variables escogidas vs. especie y playa
|
Playas y especie |
Densidad (g/cm³) |
pH |
Textura |
|
Alta_P.sexcubertulata |
0,78 |
6,08 |
6 |
|
Media_P.sexcubertulata |
0,53 |
6,14 |
6 |
|
Baja__P.sexcubertulata |
0,76 |
6,12 |
6 |
|
Tori__P.sexcubertulata |
0,77 |
6,39 |
3 |
|
Corea__P.sexcubertulata |
0,55 |
6,32 |
6 |
|
Arara__P.sexcubertulata |
0,61 |
6,64 |
6 |
|
Media_P.expansa |
0,63 |
6,12 |
6 |
|
Arara_ P.expansa |
0,5 |
6,44 |
6 |
|
Alta_P.unifilis |
0,74 |
6,28 |
3 |
|
Media_ P.unifilis |
0,68 |
6,35 |
6 |
|
Baja_ P.unifilis |
0,71 |
6,17 |
3 |
|
Tori_ P.unifilis |
0,72 |
6,21 |
3 |
|
Corea_ P.unifilis |
0,4 |
6,38 |
3 |
|
Arara_ P.unifilis |
0,52 |
6,65 |
6 |
Fuente: elaboración propia.
Tabla 3. Resultado de la estadística descriptiva aplicada a los datos escogidos
|
Estadística descriptiva |
Densidad |
pH |
Textura |
|
Media |
0,63571429 |
6,30642857 |
4,92857143 |
|
Desviación estándar |
0,11972496 |
0,18370575 |
1,49173547 |
|
Rango |
0,38 |
0,57 |
3 |
|
Mínimo |
0,4 |
6,08 |
3 |
|
Máximo |
0,78 |
6,65 |
6 |
|
N |
14 |
14 |
14 |
|
Coeficiente de variación |
18,83 |
2,91 |
30,27 |
Fuente: elaboración propia.
5.2 Análisis multitemporal
Las correcciones desarrolladas fueron un proceso único e indispensable para el óptimo tratamiento de cada imagen, logrando mejorar aspectos como distorsiones atmosféricas y errores del satélite. Con respecto a los mosaicos, teniendo en cuenta que este es un proceso que podría generar problemas radiométricos y geométricos cuando las escenas combinadas son captadas en distintos periodos del año (Sanjurjo & Kalliola, 2004), el procedimiento se desarrolló entre imágenes satelitales de un mismo periodo, específicamente del mismo mes o con uno o dos meses de diferencia, evitando fechas muy lejanas y por consiguiente, composiciones entre distintos años. La combinación de bandas no es un procedimiento imprescindible, sin embargo, se consideró pertinente realizarlo pues de esta manera se presentaron colores más vivos, en comparación con las tonalidades reales que presentan las imágenes satelitales, facilitando la diferenciación a simple vista de los distintos tipos de cobertura y así, determinar las firmas espectrales.
Cada una de las áreas de anidación presentó variaciones particulares. Playa baja, junto con la isla de Corea, han adoptado una forma alargada y puntiaguda. Respecto a playa media los cambios anuales no están representados en términos de variabilidad gradual sino drástica: en 2011 y 2012 alcanzó su máxima área, mientras que, en 2013 era casi imperceptible. Referente a playa alta, haciendo un comparativo entre 2008 y 2012 esta fue aumentado gradualmente de tamaño, siendo 2010 y 2011 los años en los que mayor extensión tuvo. Sin embargo, después de este periodo, ha ido incrementando la vegetación. Playa Arara apareció en el año 2015 cambiando notablemente de un periodo a otro, siendo 2015 y 2018 las fechas donde alcanzó el máximo tamaño, mientras que en 2016 tuvo la extensión más reducida registrada. Playa tori, entre los años 2008 y 2019, se ha visto altamente sujeta a cambios debido a la variación que la isla de Corea ha presentado. Se evidencia la reducción de su extensión año a año debido al achatamiento del brazo del río que la rodea, hacia el límite suroccidental en la frontera con Perú. Por último, en lo que respecta a Playa Corea, en comparación con las demás, es la que menor extensión posee, por lo tanto, sus variaciones no son muy notables. Las dos nuevas playas formadas a partir de 2017 no hacen parte de las zonas amparadas por el programa de conservación, sin embargo, seguramente entrarán bajo su jurisdicción pues es probable que tortugas desoven en estos lugares.
Se entiende que la disponibilidad de las áreas de anidación hace parte de un ciclo dinámico, variable y frágil pues como afirman Medina et al., (1995) “estas no son elementos estáticos sino que cambian su forma a lo largo del tiempo”. Dinámico y variable, porque están sujetas a la morfología del río, por lo tanto, no hay un factor que garantice o permita determinar que x playa saldrá en cierta temporalidad, así como tampoco se puede saber con exactitud el tamaño que esta abarcará. Y frágil, refiriéndose al efecto de factores naturales (sedimentación) y antrópicos (cambio climático) que influyen en la formación de las playas.
Las comunidades indígenas de la zona han observado y manifestado que existe una dinámica cronológica en la utilización de las playas que no solo depende de la inundación o de la disponibilidad de áreas sino del cambio en la textura del sedimento: las playas antiguas poco a poco desarrollan vegetación y no son de preferencia por las tortugas, mientras que aquellas playas jóvenes sí. El cambio en la forma de las playas también influye en la selección de zonas de anidación, así como en la cantidad de madres registradas, considerándolo como un proceso natural que depende del curso del río. Conocer y analizar estos cambios contribuye a la conservación de estas especies, especialmente para su monitoreo, así como la comprensión de sus preferencias al momento de anidar.
6. Conclusiones
Las clasificaciones supervisadas permitieron evidenciar que año a año la disponibilidad de las playas es bastante variable en cuestión de tamaño y surgimiento. Son zonas altamente inconsistentes en términos de ubicación y sujetas a diversos cambios ya sea por la morfología del río u otros factores ambientales que pueden condicionar también las características de los sedimentos. Esto puede ser un elemento positivo o negativo, positivo en el sentido de que puede haber más zonas de anidación para las tortugas y negativo porque si llegase a haber alguna alteración que retrase la formación de las mismas, las tortugas no contarían con zonas óptimas para la oviposición, generando pérdidas.
Es de gran importancia seguir incluyendo en este tipo de estudios la toma de datos de las variables físicas y químicas de los sedimentos relacionados con los sitios que utilizan las tortugas con el fin de entender la dinámica asociada con la escogencia y utilización de lugares por parte de las especies. Asimismo, este conocimiento permitirá integrar la información con el conocimiento local, pues como manifestaron los pobladores, los lugares donde anidan las tortugas corresponden a ciertas particularidades del suelo, que son de interés por parte de estos reptiles ya que tienen un sentido ecológico y biológico.
Agradecimientos
Un especial agradecimiento a las comunidades de Santa Sofía, Nuevo Jardín, El Progreso, Yahuma I y El Barranco, por el apoyo brindado. A la Asociación Curuinsi Huasi (familia Carihuasari): Rogelio (Padre), Nabil, Marcela de Silva, Rafael Conde, Rogelio (hijo) y sus niños Noemi, Pancho, Nuria, Lucía, Pedro, Randal, Karen, Mecha, Pelacho y Hortencia, por su guianza en cada momento y por compartir sus conocimientos ancestrales y experiencias vividas. Así mismo, agradecimiento a la Fundación Biodiversa Colombia por permitirnos hacer parte del programa. Finalmente, a la MSc. Constanza Garavito Muñóz por su asesoramiento durante el laboratorio de análisis de suelos.
Bibliografía
Acuña, R., Castaing, A., & Flores, F. (1983). Aspectos ecológicos de la distribución de las tortugas terrestres y semiacuáticas en el Valle Central de Costa Rica. Revista de Biología Tropical, 31 (2), 181–192. https://doi.org/10.15517/rbt.v31i2.24932
Asociación Española de Fabricantes de Agronutrientes (2019). Clasificación del pH. https://aefa-agronutrientes.org/glosario-de-terminos-utiles-en-agronutricion/clasificacion-del-ph
Andrades, M., Molenir, A., & Masaguer, A. (2015). Prácticas de edafología: métodos didácticos para análisis de suelos [en línea]. Editorial Universidad La Rioja, Logroño. ISBN: 978-84-608-5117-2. 13-14
Bull, J. (1980). Determinación sexual en reptiles. The Quarterly Review of Biology, 55 (1), 3–21. https://doi.org/10.1086/411613
Camacho, H. S. y Quiñonez, D. A. (2020). Relación entre la dinámica pluvial del río Amazonas y la formación de barras en el corregimiento de Santa Sofia (Amazonía colombiana), donde anida la tortuga charapa (Podocnemis expansa). Trabajo de grado. Programa de Ingeniería Geográfica y Ambiental. Facultad de Ciencias Ambientales y de la Sostenibilidad. Universidad de Ciencias Aplicadas y Ambientales (UDCA).
Campos, A., Oleschko, K., Cruz, L., Etchevers, B., Jorge, D. & Hidalgo C. (2001). Estimación de alófano y su relación con otros parámetros químicos en Andisoles de montaña del volcán Cofre de Perote. Revista Terra Latinoamericana, 19 (2), 105-116.
FAO (2021). Procedimiento operativo estándar para el análisis de carbonato de calcio equivalente en suelo-Método de titulación. Roma. http://www.fao.org/3/ca8621es/ca8621es.pdf
Figueiredo, J., Hoorn, C., van der Ven, P., & Soares, E. (2010). Late Miocene onset of the Amazon River and the Amazon deep-sea fan: Evidence from the Foz do Amazonas Basin: Reply. Geology, 38 (7), 213. https://doi.org/10.1130/G31057Y.1
Arbeláez, F., Gutiérrez, D., Cadavid, A., Premauer, A., & Vargas-Ramírez, M. (2009). Initial actions towards the conservation of three species of endangered river turtles in the Colombian Amazonia. Community-bases nests monitoring and educational pilot programs. Fundación BioDiversa Colombia. https://www.fundacionbiodiversa.org/wordpress/wp-content/uploads/2014/08/Final-report-2008.pdf
Fundación BioDiversa Colombia (2015). Empoderamiento de los Grupos Locales de Conservación. Fundación BioDiversa Colombia. https://www.fundacionbiodiversa.org/wordpress/como-empoderamos-grupos-locales-de-conservacion/
Gardi, C., Angelini, M., Barceló, S., Comerma, J., Cruz Gaistardo, C., Encina Rojas, A., Jones, A., Krasilnikov, P., Mendonça Santos Brefin, M. L., Montanarella, L., Muniz Ugarte, O., Schad, P., Vara Rodríguez, M.I., & Vargas, R. (eds.) (2014). Atlas de suelos de América Latina y el Caribe, Comisión Europea-Oficina de Publicaciones de la Unión Europea, L-2995 Luxembourg, 176 pp.
GLOBE (2005). Un vistazo a la investigación de suelos. Global Learning and Observation to Benefit the Environment-NASA, p. 15.
González-Zárate, A, Montenegro, O. L., & Castaño-Mora, O. V. (2011). Caracterización del hábitat de la tortuga de río Podocnemis lewyana, en el río prado, aguas abajo del embalse de hidroprado, Tolima, Colombia. Revista Caldasia, 33 (2), 471-493.http://www.scielo.org.co/pdf/cal/v33n2/v33n2a11.pdf
Hernández, L. (2020). [Caracterización de la playa Los cocos sector Mendihuaca-Magdalena durante el seguimiento de la temporada de anidación de tortugas marinas 2019. Tesis de Pregrado, Universidad Jorge Tadeo Lozano]. http://repositorio.unan.edu.ni/2986/1/5624.pdf
Ceballos-Fonseca, C. (2004). Distribución de playas de anidación y áreas de alimentación de tortugas marinas y sus amenazas en el caribe colombiano. Boletín de Investigaciones Marinas y Costeras (INVEMAR), 33 (1).
Junk, W. J. & Wantzen K. M. (2004). The Flood Pulse Concept: New Aspects, Approaches and Applications. Max-Planck-Institute for Limnology, Working Group Tropical Ecology, P.O. Box 165, 24302
Lizcano, R., Olivera, D., Saavedra, D., Machado, L., Rolando, E., Moreni, M., & Fidel, M. (2017). Muestreo de suelos, técnicas de laboratorio e interpretación de análisis de suelos. Centro de Formación Agroindustrial La Angostura, Servicio Nacional de Aprendizaje (SENA) y Sistema de Investigación, Desarrollo Tecnológico e Innovación (SENNOVA), p. 47.
López, D., & Torres, A. (2017). Diplomado en análisis de información geoespacial: análisis de datos tipo raster. Consejo Nacional de Ciencia y Tecnología y Centro de Investigación en Geografía y Geomática. Ciudad de México, México (p. 6).
Martínez-Callejas, S.; Trujillo, F.; Quinche, C; Millán, J. & Antelo R. (2013). Guía práctica para el cuidado y conservación de nidadas de tortuga y terecay. Fundación Omacha, Fundación Palmarito. Cartilla divulgativa serie de especies amenazadas. Bogotá, D.C., Colombia, 40 pp.
Márquez, R. (2000). Las tortugas marinas y nuestro tiempo (No. 597). Fondo de Cultura económica. http://www.bio-nica.info/Biblioteca/Marquez1996LasTortugasMarinas.pdf
Matellanes, R. (2017). Composiciones RGB de imágenes satélite. Geoinnova. https://geoinnova.org/blog-territorio/composiciones-rgb-de-imagenes-satelite/
May, F., MacDonald, C., Méndez, A., & Muñóz, M. (2018). Caracterización físico-química de las playas Barú-Guapil para la anidación y el desarrollo óptimo de la tortuga lora Lepidochelys olivacea en Hacienda Barú, Puntarenas. Revista Gaudeamus, 10 (1), 1-16. https://revistas.ulatina.ac.cr/index.php/gaudeamus/article/view/186
McKean, S. (1993). Manual de análisis de suelos y tejido vegetal: una guía teórica y práctica de metodologías. Centro Internacional de Agricultura Tropical-CIAT. Palmira, Colombia.
Meaden, G., & Kapetsky, J. (1992). La telepercepción como fuentes de datos. En G. Meaden & J. Kapetsky (Ed.), Los sistemas de información geográfica y la telepercepción en la pesca continental y la acuicultura (45-98). Roma, Italia.
Medina, R., Losada, I., Losada, M. A., & Vidal, C. (1995). Variabilidad de los perfiles de playa: forma y distribución granulométrica. Revista Ingeniería del Agua, 2 (1), 133-142. https://doi.org/10.4995/ia.1995.2668
OILM. (2011). Guía OILM G-14: Medición de densidad. Organización Internacional de Metrología Legal. https://www.oiml.org/en/publications/other-language-translations/spanish/g014-es11.pdf
Pezzuti, J. C., Lima, J. P., da Silva, D. F., & Begossino, A. (2010). Uses and taboos of turtles and tortoises along Rio Negro, Amazon basin. Journal of Ethnobiology, 30 (1), 153-168. https://doi.org/10.2993/0278-0771-30.1.153
Pineda, R. (2013). El río Amazonas: un gigante indomado. Una mirada hacia su historia contemporánea (1500-2010). Boletín Cultural y Bibliográfico, 47 (84), 36-65. https://publicaciones.banrepcultural.org/index.php/boletin_cultural/article/view/117/115
Ramiro Vásquez, E., & Caballero, A. (2011). Inconsistencia del Coeficiente de Variación para expresar la variabilidad de un experimento en un modelo de Análisis de Varianza. Cultivos Tropicales, 32 (3), 42-45. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0258-59362011000300006&lng=es&tlng=es
Reuter, F. (2002). Transformaciones de la imagen: clasificaciones supervisadas y no supervisadas. Facultad de Ciencias. Universidad Nacional de Santiago del Estero. Santiago del Estero, Argentina, 102–122.
Rosenzweig, M. (1981). A theory of habitat selection. Journal of Ecology, 62 (2), 327–335. https://doi.org/10.2307/1936707
Sanjurjo, J., & Kalliola, R. (2004). Manual para la elaboración de mosaicos de imágenes de satélite Landsat TM para la selva baja peruana (documento técnico no. 03). Instituto de Investigaciones de la Amazonía Peruana (IIAP), Universidad de Turku, Biota BD Oy y Universidad Nacional de la Amazonía Peruana. Iquitos-Perú, (p. 29).
Santaella, G., & González, A. (1965). Influencia del carbonato de calcio en las propiedades químicas de un suelo de la terraza de Villa-rica (Cauca). Revista Acta Agronómica, 15 (1–4), 33–59. https://revistas.unal.edu.co/index.php/acta_agronomica/article/view/48927
Sarmiento-Ramírez, J., Abella, E., Martín, M. P., Tellería, M. T., López-Jurado, L. F., Marco, A., & Diéguez-Uribeondo, J. (2010). Fusarium solani is responsible for massmortalities in nests of loggerhead sea turtle, Caretta caretta, in Boavista, Cape Verde. FEMS Microbiology Letters, 312(2), 192-200. https://doi.org/10.1111/j.1574-6968.2010.02116.x
SIAT-AC (2015). Subregiones de la Amazonía colombiana. Sistema de Información Ambiental Territorial de la Amazonía colombiana. http://siatac.co/web/guest/region/subregiones
USDA, & NRCS (2000). Cálculo de la húmedad del huelo por tacto y apariencia. Program Aid 1619-SP. Departamento de Agricultura de los Estados Unidos, p. 13.
Valenzuela-Carpio, J. (2019). [Cuantificación de la capacidad de transporte de sedimentos en el río Amazonas, Loreto, Perú. Tesis de Pregrado, Universidad Nacional Mayor de San Marcos], Lima, Perú.
1 Facultad de Ciencias Ambientales y de la Sostenibilidad, Universidad de Ciencias Aplicadas y Ambientales (UDCA), Colombia, correo electrónico: vale_franco25@hotmail.com. ORCID: https://orcid.org/0000-0002-6571-7892
2 Investigaciones Geográficas para el Desarrollo Territorial (INGEDET), Facultad de Ciencias Ambientales y de la Sostenibilidad, Universidad de Ciencias Aplicadas y Ambientales (UDCA), Colombia, correo eletrónico: javierdiaz@fundacionbiodiversaorg. ORCID: https://orcid.org/0000-0002-2454-047X
3 Coordinadores Grupos Locales de Conservación (Guardianes de las tortugas), desde 2008, Curuinsi Huasi.